Calor sensible vs. latente: claves en transferencia térmica
¿Alguna vez te has preguntado por qué el hielo se derrite sin aumentar su temperatura o cómo el agua hierve manteniéndose a 100 °C? Estos fenómenos se explican mediante dos conceptos fundamentales en la termodinámica: el calor sensible y el calor latente. Comprender la diferencia entre ambos es esencial para diversas aplicaciones, desde la climatización hasta procesos industriales.
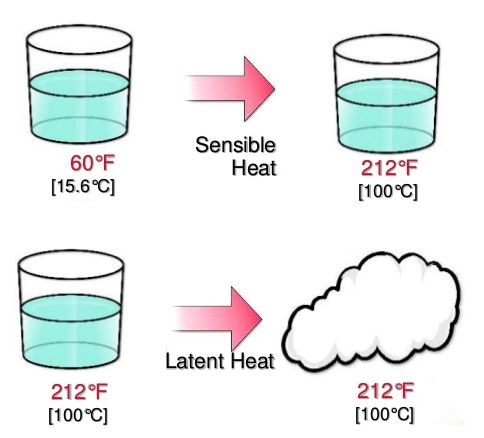
¿Qué es el Calor Sensible?
El calor sensible es la energía térmica que, al ser transferida a una sustancia, provoca un cambio en su temperatura sin alterar su estado físico. Es decir, al añadir o remover calor sensible, la temperatura de la sustancia aumenta o disminuye, pero permanece en la misma fase (sólido, líquido o gas).
Fórmula del Calor Sensible:
Q = m × c × ΔT
Donde:
- Q es el calor sensible (en julios o calorías).
- m es la masa de la sustancia (en kilogramos o gramos).
- c es el calor específico de la sustancia (en J/kg·°C o cal/g·°C).
- ΔT es el cambio de temperatura (en °C).
Ejemplo:
Si calentamos 1 kg de agua desde 20 °C hasta 80 °C, el calor sensible absorbido se calcula así:
- m = 1 kg
- c (agua) = 4,186 J/kg·°C
- ΔT = 80 °C - 20 °C = 60 °C
Q= 1 kg × 4,186 J/kg\°C × 60 °C = 251,160 J
Por lo tanto, se requieren 251,160 julios para aumentar la temperatura del agua en 60 °C.
¿Qué es el Calor Latente?
El calor latente es la energía térmica que una sustancia absorbe o libera durante un cambio de estado físico (como fusión, vaporización o solidificación) sin que ocurra una variación en su temperatura. Este calor se utiliza para romper o formar enlaces intermoleculares durante la transición de fase.
Tipos de Calor Latente:
- Calor Latente de Fusión: Energía necesaria para cambiar una sustancia de sólido a líquido.
- Calor Latente de Vaporización: Energía requerida para transformar una sustancia de líquido a gas.
Fórmula del Calor Latente:
Q = m × L
Donde:
- Q es el calor latente (en julios o calorías).
- m es la masa de la sustancia (en kilogramos o gramos).
- L es el calor latente específico de la sustancia (en J/kg o cal/g).
Ejemplo:
Para convertir 500 g de hielo a 0 °C en agua líquida a 0 °C:
- m = 500 g = 0.5 kg
- L (fusión del hielo) = 334,000 J/kg
Q = 0.5 kg × 334,000 J/kg = 167,000 J
Se necesitan 167,000 julios para fundir 500 g de hielo sin cambiar su temperatura.
Diferencias Clave entre Calor Sensible y Calor Latente
- Cambio de Temperatura:
- Calor Sensible: Provoca variación de temperatura sin cambio de estado.
- Calor Latente: Induce cambio de estado sin alterar la temperatura.
- Percepción:
- Calor Sensible: Detectable mediante termómetros.
- Calor Latente: No detectable por termómetros durante el cambio de fase.
- Aplicaciones:
- Calor Sensible: Relevante en calefacción y enfriamiento sin cambios de fase.
- Calor Latente: Crucial en procesos de fusión, vaporización y condensación.
Importancia en la Vida Cotidiana y Aplicaciones
- Climatización: Los sistemas HVAC deben considerar ambos tipos de calor para mantener condiciones confortables en interiores.
- Cocina: Al hervir agua, se aplica calor sensible hasta alcanzar 100 °C; luego, el calor latente permite la vaporización sin aumento de temperatura.
- Refrigeración: Los refrigeradores extraen calor latente para congelar alimentos, manteniendo su temperatura constante durante el cambio de fase.
Comprender la distinción entre calor sensible y calor latente es esencial para analizar cómo se transfiere la energía térmica en diversos procesos naturales e industriales. Esta comprensión facilita el diseño eficiente de sistemas de calefacción, refrigeración y climatización, optimizando el consumo energético y mejorando el confort en nuestro entorno.