Entalpía: energía oculta en cada cambio de estado
¿Sabías que cuando el agua hierve o el hielo se derrite, hay una energía oculta trabajando que no podemos ver directamente? Esa energía se llama entalpía, y aunque no la percibimos a simple vista, juega un papel crucial en procesos como la climatización, los cambios de estado y la termodinámica en general. En este blog, exploraremos qué es la entalpía, cómo se mide, su importancia en sistemas HVAC, y cómo influye en nuestra vida cotidiana.
¿Qué es la Entalpía?
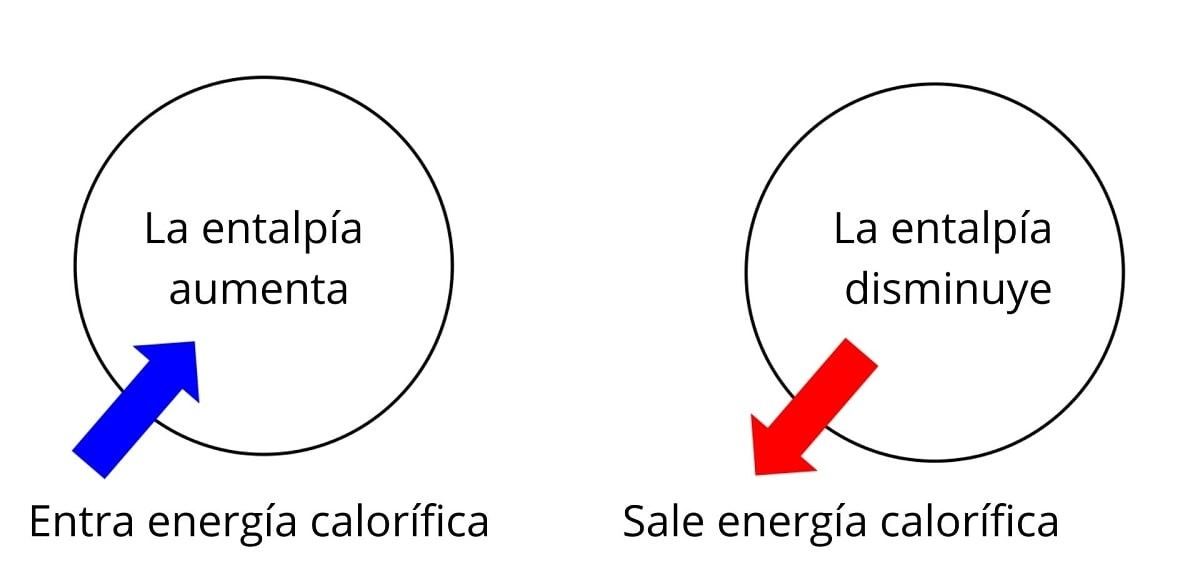
La entalpía (H) es una magnitud termodinámica que representa el contenido total de energía de un sistema, incluyendo su energía interna y la energía asociada al trabajo de expansión (presión y volumen). En otras palabras, es la energía total de un sistema que puede intercambiarse con el entorno.
Se expresa matemáticamente como:
H = U + P ⋅ V
Donde:
- H es la entalpía (en julios o calorías).
- U es la energía interna del sistema.
- P es la presión (en pascales).
- V es el volumen (en metros cúbicos).
¿Por Qué es Importante la Entalpía?
La entalpía es fundamental porque ayuda a calcular la energía que un sistema intercambia con su entorno durante procesos como el calentamiento, enfriamiento, fusión o evaporación. A diferencia de la energía interna, la entalpía considera también el trabajo realizado por el sistema debido a cambios de volumen bajo presión constante, lo cual es esencial en aplicaciones prácticas.
Por ejemplo:
- En sistemas HVAC, la entalpía ayuda a determinar la cantidad de energía necesaria para climatizar un espacio.
- En procesos industriales, permite calcular la eficiencia de sistemas térmicos y de generación de energía.
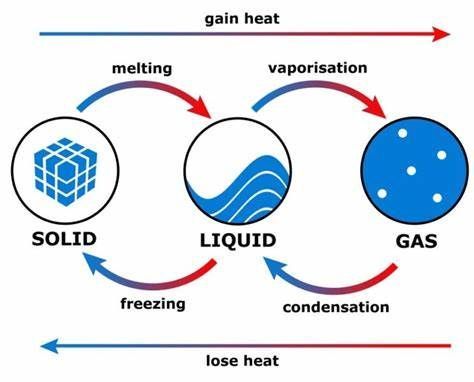
¿Cómo se Relaciona la Entalpía con los Cambios de Estado?
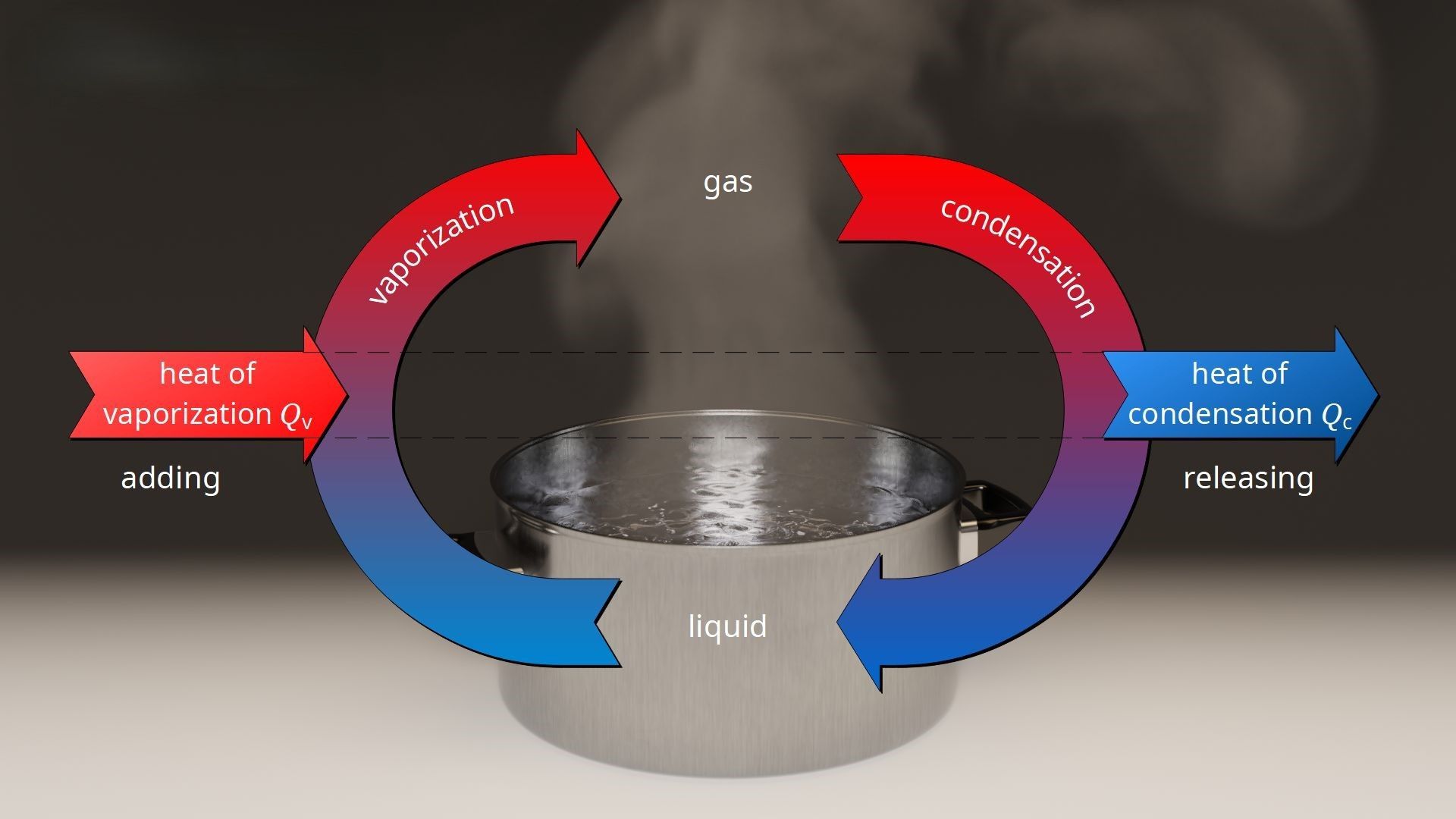
La entalpía juega un papel crucial durante los cambios de estado (como fusión, vaporización o condensación), ya que describe la cantidad de energía requerida para realizar esos procesos:
- Entalpía de Fusión: Energía necesaria para convertir un sólido en líquido sin cambiar su temperatura.
- Entalpía de Vaporización: Energía necesaria para transformar un líquido en gas.
- Entalpía de Condensación: Energía liberada cuando un gas se convierte en líquido.
Ejemplo: Cuando el agua pasa de líquido a vapor a 100°C, su entalpía aumenta debido al calor absorbido, aunque su temperatura no cambia.
La Entalpía en Sistemas HVAC
En sistemas de climatización, la entalpía es una herramienta esencial para medir y controlar la energía asociada al aire que circula.
En el diseño de sistemas HVAC, se utiliza para:
- Calcular el Consumo Energético:
- Determina la cantidad de energía necesaria para enfriar o calentar el aire en un espacio.
- Evaluar la Eficiencia de Sistemas:
- Mide cuánta energía se intercambia entre el aire y los sistemas de refrigeración o calefacción.
- Análisis Psicrométrico:
- En la carta psicrométrica, la entalpía aparece como líneas diagonales que permiten calcular el contenido de energía del aire húmedo.
Ejemplo en HVAC:
Imagina un sistema de aire acondicionado que enfría aire desde una temperatura de 30°C con 70% de humedad relativa hasta una temperatura de 20°C con 50% de humedad relativa. Usando la carta psicrométrica, puedes calcular la diferencia de entalpía entre ambas condiciones para determinar la cantidad de energía requerida para ese proceso.
¿Cómo se Mide la Entalpía?
Aunque no se mide directamente con un instrumento, la entalpía se calcula utilizando datos como la presión, temperatura y volumen del sistema. En la práctica, los ingenieros utilizan:
- Carta Psicrométrica: Para calcular la entalpía del aire húmedo en sistemas HVAC.
- Tablas Termodinámicas: Para obtener valores de entalpía en procesos industriales.
- Software de Simulación: Herramientas avanzadas que integran fórmulas termodinámicas para calcular la entalpía en sistemas complejos.
Ejemplo Práctico: La Entalpía en el Agua
Imagina que calientas 1 kg de agua desde 25°C hasta que hierve y luego se convierte en vapor. La entalpía involucrada en este proceso se divide en dos partes:
- Calor Sensible: Energía necesaria para llevar el agua de 25°C a 100°C.
Fórmula: Q = m ⋅ c ⋅ ΔT
- Q= 1 kg ⋅ 4,186 J/kg\°C ⋅ (100 − 25)
- Q = 313,950 J
- Calor Latente (Entalpía de Vaporización): Energía necesaria para convertir el agua a 100°C en vapor.
Fórmula: Q = m ⋅ L
- Q= 1 kg ⋅ 2,260,000 J/kg
- Q=2,260,000 J
En total, se necesitan 313,950 + 2,260,000 = 2,573,950 J para completar el proceso.
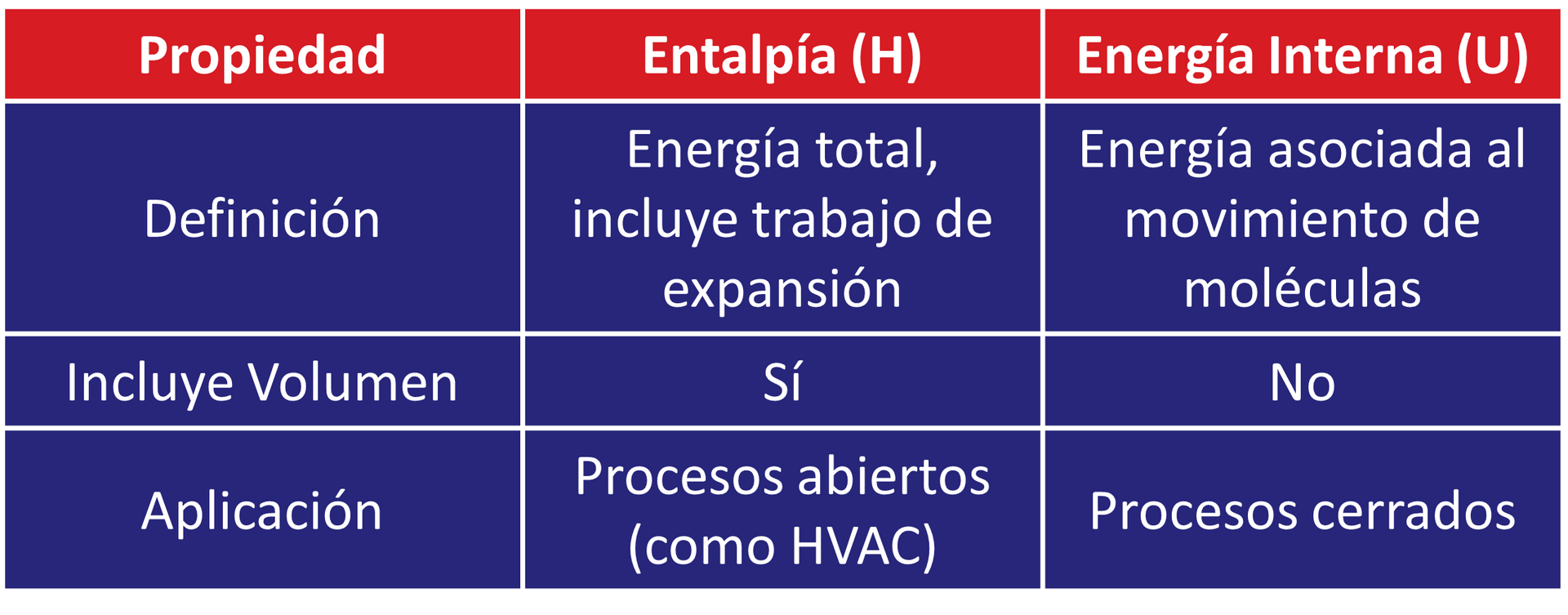
Diferencia Entre Entalpía y Energía Interna
Aunque están relacionadas, la entalpía y la energía interna no son lo mismo:
Conclusión
La entalpía es una herramienta esencial para entender los intercambios de energía térmica en nuestro entorno. Desde sistemas HVAC hasta procesos industriales y cambios climáticos, este concepto nos ayuda a diseñar y optimizar sistemas que garantizan eficiencia energética y confort. La próxima vez que sientas el aire fresco de un aire acondicionado o observes cómo hierve el agua, recuerda que detrás de esos procesos está trabajando la entalpía.