Calor específico: cómo los materiales almacenan energía térmica
¿Por qué el agua tarda tanto en calentarse o enfriarse, mientras que el metal se calienta casi de inmediato? La respuesta está en un concepto fundamental de la termodinámica: el calor específico. Este parámetro es crucial para entender cómo los materiales reaccionan a la energía térmica, y tiene aplicaciones prácticas en la climatización, la industria y hasta en nuestra vida diaria.

¿Qué es el Calor Específico?
El calor específico se define como la cantidad de energía térmica necesaria para aumentar la temperatura de una unidad de masa de una sustancia en un grado Celsius (°C) o Kelvin (K). Básicamente, mide la "capacidad" de un material para almacenar calor.
Fórmula del Calor Específico:
c = Q /(m⋅ΔT)
Donde:
- c es el calor específico (J/kg·°C o cal/g·°C).
- Q es la cantidad de calor transferido (en julios o calorías).
- m es la masa de la sustancia (en kilogramos o gramos).
- ΔT es el cambio de temperatura (en °C o K).
El calor específico depende de la naturaleza del material. Por ejemplo:
- Agua: 4,186 J/kg·°C (muy alto, lo que explica por qué tarda en calentarse).
- Aluminio: 900 J/kg·°C.
- Hierro: 450 J/kg·°C.
¿Cómo se Mide el Calor Específico?
El calor específico se mide utilizando calorímetros, instrumentos que determinan la cantidad de energía térmica transferida a o desde una sustancia. Un ejemplo es el calorímetro de mezcla, que permite calcular el calor específico al combinar una sustancia de temperatura conocida con otra de diferente temperatura y medir el equilibrio térmico alcanzado.

Importancia del Calor Específico
El calor específico tiene un papel crucial en numerosas áreas:
- Climatización y HVAC:
- Los ingenieros usan el calor específico para calcular cómo se comportarán los materiales en sistemas de calefacción y enfriamiento. Por ejemplo, el agua, con su alto calor específico, es ideal para sistemas hidrónicos, ya que puede almacenar y transferir grandes cantidades de energía térmica.
- Industria:
- En la fabricación, el calor específico ayuda a determinar cómo calentar o enfriar materiales durante los procesos de producción, como la fundición de metales o el secado de productos.
- Naturaleza y Clima:
- El agua, con su alto calor específico, regula el clima de la Tierra al almacenar grandes cantidades de calor en los océanos, liberándolo lentamente durante el invierno.
Ejemplo Práctico
Imagina que deseas calentar 2 litros de agua (2 kg) de 20°C a 80°C utilizando una resistencia eléctrica. ¿Cuánto calor necesitas?
Datos:
- m = 2 kg.
- ΔT = 80°C - 20°C = 60°C.
- c (agua) = 4,186 J/kg·°C.
Cálculo:
Q = m ⋅ c ⋅ ΔT
Q = 2 kg ⋅ 4,186 J/kg\°C ⋅ 60 °C
Q = 502,320 J (o aproximadamente 502 kJ)
Esto significa que necesitas 502 kJ de energía para calentar el agua.
Comparaciones: Calor Específico en Diferentes Materiales
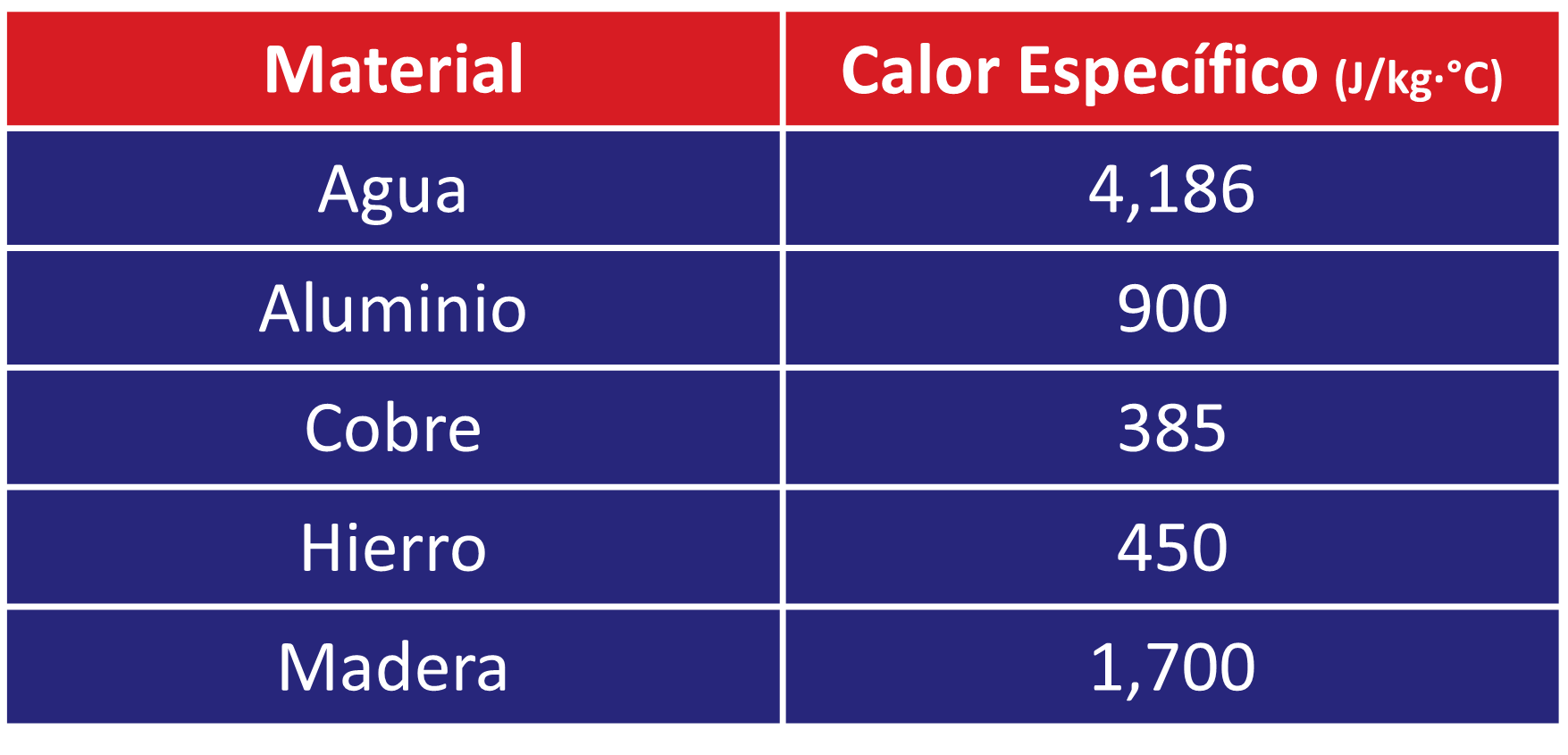
Como se puede observar, el agua tiene uno de los calores específicos más altos, lo que la convierte en un excelente medio para transportar y almacenar energía térmica.
Aplicaciones del Calor Específico
- Construcción:
- Los materiales con bajo calor específico (como los metales) se usan para estructuras que deben disipar calor rápidamente. Por otro lado, materiales con calor específico alto se utilizan para aislar o almacenar energía térmica.
- Cocina:
- Entender el calor específico ayuda a explicar por qué las sartenes de cobre calientan rápido y por qué el agua tarda más en hervir.
- Sistemas de Enfriamiento:
- En la refrigeración, líquidos con calores específicos adecuados se seleccionan para maximizar la eficiencia.
Conclusión
El calor específico es un concepto esencial para entender cómo los materiales reaccionan al calor y cómo se puede utilizar esta energía de manera eficiente. Desde los sistemas HVAC hasta los océanos que moderan nuestro clima, este parámetro tiene un impacto significativo en la vida cotidiana y en la tecnología moderna. La próxima vez que hiervas agua o utilices tu aire acondicionado, recuerda que el calor específico está detrás de todo ese proceso.